题目
在真空的容器中放入固态的NH4HS,于25℃下分解为NH3(g)与H2S(g),平衡时容器内的压力为66.66 kPa。(1) 当放入NH4HS时容器内已有39.99 kPa的H2S(g),求平衡时容器中的压力.(2) 容器内原有6。666 kPa的NH3(g),问需加多大压力的H2S,才能形成NH4HS?
在真空的容器中放入固态的NH4HS,于25℃下分解为NH3(g)与H2S(g),平衡时容器内的压力为66.66 kPa。
(1) 当放入NH4HS时容器内已有39.99 kPa的H2S(g),求平衡时容器中的压力.
(2) 容器内原有6。666 kPa的NH3(g),问需加多大压力的H2S,才能形成NH4HS?
题目解答
答案
解:反应的化学计量式如下: NH4HS(s)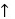 NH3(g)+H2S(g)
NH3(g)+H2S(g)
由题给条件,25℃下,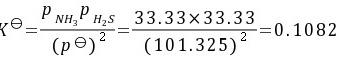
(1) 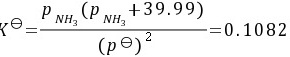
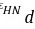 =18.873kPa p=39。99+2
=18.873kPa p=39。99+2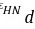 =77.735 kPa
=77.735 kPa
(2) 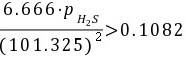
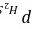 >166。65 kPa
>166。65 kPa
4。 已知A,B两组分体系在 下的相图(T—x图)如下图所示。
下的相图(T—x图)如下图所示。
1)标出各区的相态;2)水平线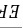 ,
,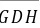 和垂线
和垂线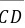 上体系的条件自由度是多少(列出计算过程)?
上体系的条件自由度是多少(列出计算过程)?
3)在右图中画出a,b,c点冷却的步冷曲线。(本题共12分)
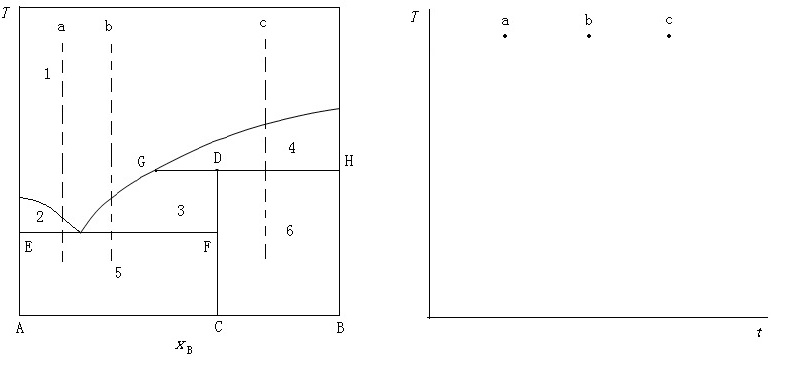
解:(1) (6分)
1 | 2 | 3 | 4 | 5 | 6 |
l | A+l | C+l | B+l | A+C | C+B |
(2) 、线: (2分)
垂线: (1分)
(3分)
解析
步骤 1:确定反应方程式和平衡常数
反应方程式为:NH4HS(s) → NH3(g) + H2S(g)
平衡常数表达式为:$K_p = \frac{P_{NH_3} \cdot P_{H_2S}}{P_{\theta}^2}$,其中$P_{\theta}$为标准压力,通常取101.325 kPa。
步骤 2:计算平衡常数
根据题目,平衡时容器内的压力为66.66 kPa,即$P_{NH_3} = P_{H_2S} = 33.33$ kPa。代入平衡常数表达式,得到$K_p = \frac{33.33 \times 33.33}{101.325^2} = 0.1082$。
步骤 3:计算(1)中平衡时容器中的压力
当容器内已有39.99 kPa的H2S(g),设平衡时NH3(g)的压力为$P_{NH_3}$,则$P_{H_2S} = 39.99 + P_{NH_3}$。代入平衡常数表达式,得到$0.1082 = \frac{P_{NH_3} \cdot (39.99 + P_{NH_3})}{101.325^2}$。解得$P_{NH_3} = 18.873$ kPa,因此平衡时容器中的压力为$P_{NH_3} + P_{H_2S} = 18.873 + 39.99 = 58.863$ kPa。
步骤 4:计算(2)中需加多大压力的H2S
当容器内原有6.666 kPa的NH3(g),设需加的压力为$P_{H_2S}$,则$P_{NH_3} = 6.666$ kPa。代入平衡常数表达式,得到$0.1082 = \frac{6.666 \cdot P_{H_2S}}{101.325^2}$。解得$P_{H_2S} = 166.65$ kPa。
反应方程式为:NH4HS(s) → NH3(g) + H2S(g)
平衡常数表达式为:$K_p = \frac{P_{NH_3} \cdot P_{H_2S}}{P_{\theta}^2}$,其中$P_{\theta}$为标准压力,通常取101.325 kPa。
步骤 2:计算平衡常数
根据题目,平衡时容器内的压力为66.66 kPa,即$P_{NH_3} = P_{H_2S} = 33.33$ kPa。代入平衡常数表达式,得到$K_p = \frac{33.33 \times 33.33}{101.325^2} = 0.1082$。
步骤 3:计算(1)中平衡时容器中的压力
当容器内已有39.99 kPa的H2S(g),设平衡时NH3(g)的压力为$P_{NH_3}$,则$P_{H_2S} = 39.99 + P_{NH_3}$。代入平衡常数表达式,得到$0.1082 = \frac{P_{NH_3} \cdot (39.99 + P_{NH_3})}{101.325^2}$。解得$P_{NH_3} = 18.873$ kPa,因此平衡时容器中的压力为$P_{NH_3} + P_{H_2S} = 18.873 + 39.99 = 58.863$ kPa。
步骤 4:计算(2)中需加多大压力的H2S
当容器内原有6.666 kPa的NH3(g),设需加的压力为$P_{H_2S}$,则$P_{NH_3} = 6.666$ kPa。代入平衡常数表达式,得到$0.1082 = \frac{6.666 \cdot P_{H_2S}}{101.325^2}$。解得$P_{H_2S} = 166.65$ kPa。