题目
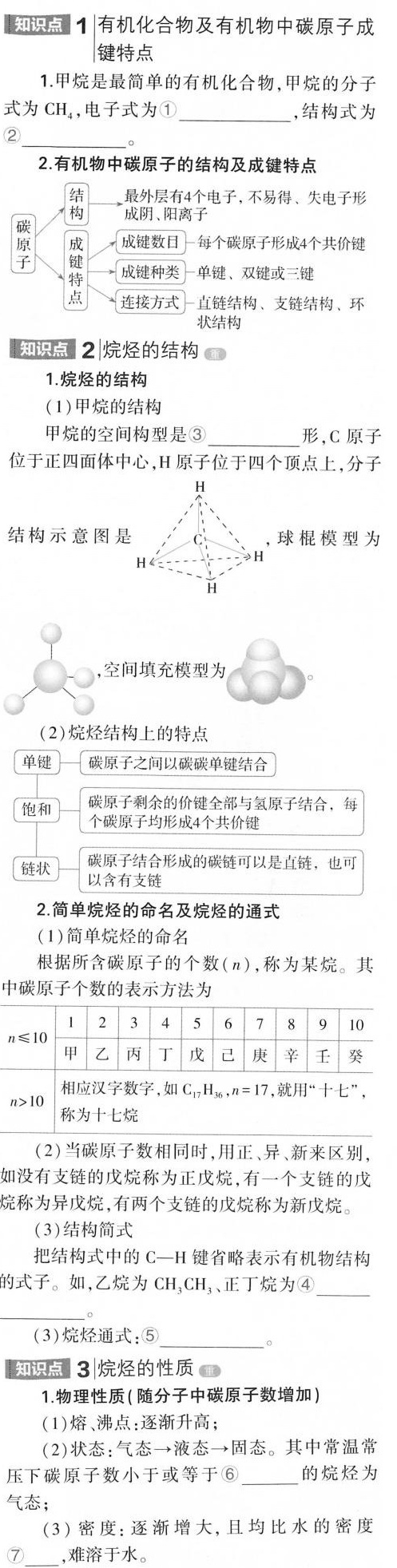
知识点1有机化合物及有机物中碳原子成-|||-键特点-|||-1.甲烷是最简单的有机化合物,甲烷的分子-|||-式为CH4,电子式为① __ ,结构式为-|||-② __-|||-2.有机物中碳原子的结构及成键特点-|||-结 最外层有4个电子,不易得、失电子形-|||-构 成阴、阳离子-|||-学 霉 成键数目一每个碳原子形成4个共价键-|||-成键种类 一单键、双键或三键-|||-点 连接方式 一直链结构、支链结构、环-|||-状结构-|||-(1)甲烷的结构-|||-甲烷的空间构型是③ __ 形,C原子-|||-位于正四面体中心,H原子位于四个顶点上,分子-|||-H-|||-结构示意图是 ,球棍模型为-|||-H-|||-H-|||-,空间填充模型为-|||-(2)烷烃结构上的特点-|||-单键 碳原子之间以碳碳单键结合-|||-饱和 碳原子剩余的价键全部与氢原子结合,每-|||-个碳原子均形成4个共价键-|||-链状 以含有支链-|||-碳原子结合形成的碳链可以是直链,也可-|||-2.简单烷烃的命名及烷烃的通式-|||-(1)简单烷烃的命名-|||-根据所含碳原子的个数(n),称为某烷。其-|||-中碳原子个数的表示方法为-|||-1 2 3 4 5 6 7 8 9 10-|||-leqslant 10-|||-甲 乙 丙 丁 戊 已 庚 辛 壬 癸-|||-gt 10 称为十七烷-|||-相应汉字数字,如 _(17)(H)_(36),n=17 ,就用"十七",-|||-(2)当碳原子数相同时,用正、异、新来区别-|||-如没有支链的戊烷称为正戊烷,有一个支链的戊-|||-烷称为异戊烷,有两个支链的戊烷称为新戊烷。-|||-(3)结构简式-|||-把结构式中的 C-H 键省略表示有机物结构-|||-的式子。如,乙烷为C H3CH3、正丁烷为④ __-|||-__-|||-(3)烷烃通式:⑤ __ _。-|||-知识点3 烷烃的性质-|||-1.物理性质(随分子中碳原子数增加)-|||-(1)熔、沸点:逐渐升高;-|||-(2)状态:气态→液态→固态。其中常温常-|||-压下碳原子数小于或等于⑥ __ 的烷烃为-|||-气态;-|||-(3)密度:逐渐增大,且均比水的密度-|||-⑦ ,难溶于水。
题目解答
答案
解析
考查要点:本题主要考查甲烷的结构、有机物中碳原子的成键特点、烷烃的命名与通式、物理性质变化规律等知识点。
解题核心:
- 甲烷的结构:掌握甲烷的电子式、结构式及空间构型(正四面体型)。
- 碳的成键特点:理解碳原子通过共价键形成链状或环状结构的特点。
- 烷烃的通式:根据碳原子形成4个单键推导通式$C_nH_{2n+2}$。
- 物理性质:明确烷烃状态、熔沸点、密度随碳原子数变化的规律。
1. 甲烷的结构
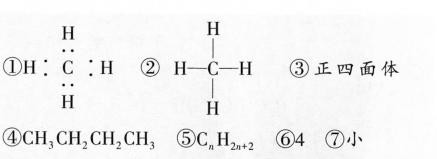
① 电子式:
碳原子最外层4个电子,与4个氢原子各共享一对电子,电子式为:
$\text{H}:\overset{\cdot\cdot}{C}:\text{H}$
(注:实际书写时需标出所有共用电子对)
② 结构式:
用单线表示原子间共价键,结构式为:
$\text{H-C-H}$
③ 空间构型:
甲烷分子为正四面体结构,碳原子在中心,氢原子在四个顶点。
2. 烷烃的结构与命名
④ 正丁烷的结构简式:
直链烷烃的结构简式需体现最长碳链,正丁烷为:
$\text{CH}_3\text{CH}_2\text{CH}_2\text{CH}_3$
⑤ 烷烃通式:
每个碳原子形成4个单键,末端碳连接3个H,中间碳连接2个H,通式为:
$C_nH_{2n+2}$
3. 烷烃的物理性质
⑥ 气态烷烃的碳原子数:
常温下,碳原子数$n \leq 4$的烷烃为气态(如甲烷、乙烷、丙烷、丁烷)。
⑦ 密度特点:
烷烃密度比水小,且随碳原子数增加逐渐增大。