题目
1.5 0℃时氯甲烷(CH3Cl )气体的密度ρ随压力p的变化如下:-|||-/kPa 101.325 67.550 50.663 33.775 25.331-|||-rho /(gcdot (dm)^-3) 2.3074 1.5263 1.1401 0.7571 0.5666-|||-试由 dfrac (P)(P)-P 关系求CH3Cl的相对分子质量。
题目解答
答案
解析
步骤 1:理解理想气体状态方程
理想气体状态方程为 $PV=nRT$,其中 $P$ 是压力,$V$ 是体积,$n$ 是物质的量,$R$ 是理想气体常数,$T$ 是温度。对于真实气体,当压力趋于零时,上述关系才成立。因此,可以使用 $\lim _{p\rightarrow 0}(\dfrac {pRT}{p})=RT\lim _{p\rightarrow 0}(\dfrac {p}{p})=M$ 来求解相对分子质量 $M$。
步骤 2:计算 $\rho {\rho }^{-1}$
根据题目给出的数据,计算 $\rho {\rho }^{-1}$,即 $\dfrac {p}{\rho }$,并列出表格。
$p/kPa$ 101.325 67.550 50.663 33.775 25.331
$\rho {\rho }^{-1}/({10}^{-3}g\cdot {dm}^{-3}\cdot kp{a}^{-1})$ 22.772 22.595 22.504 22.416 22.368
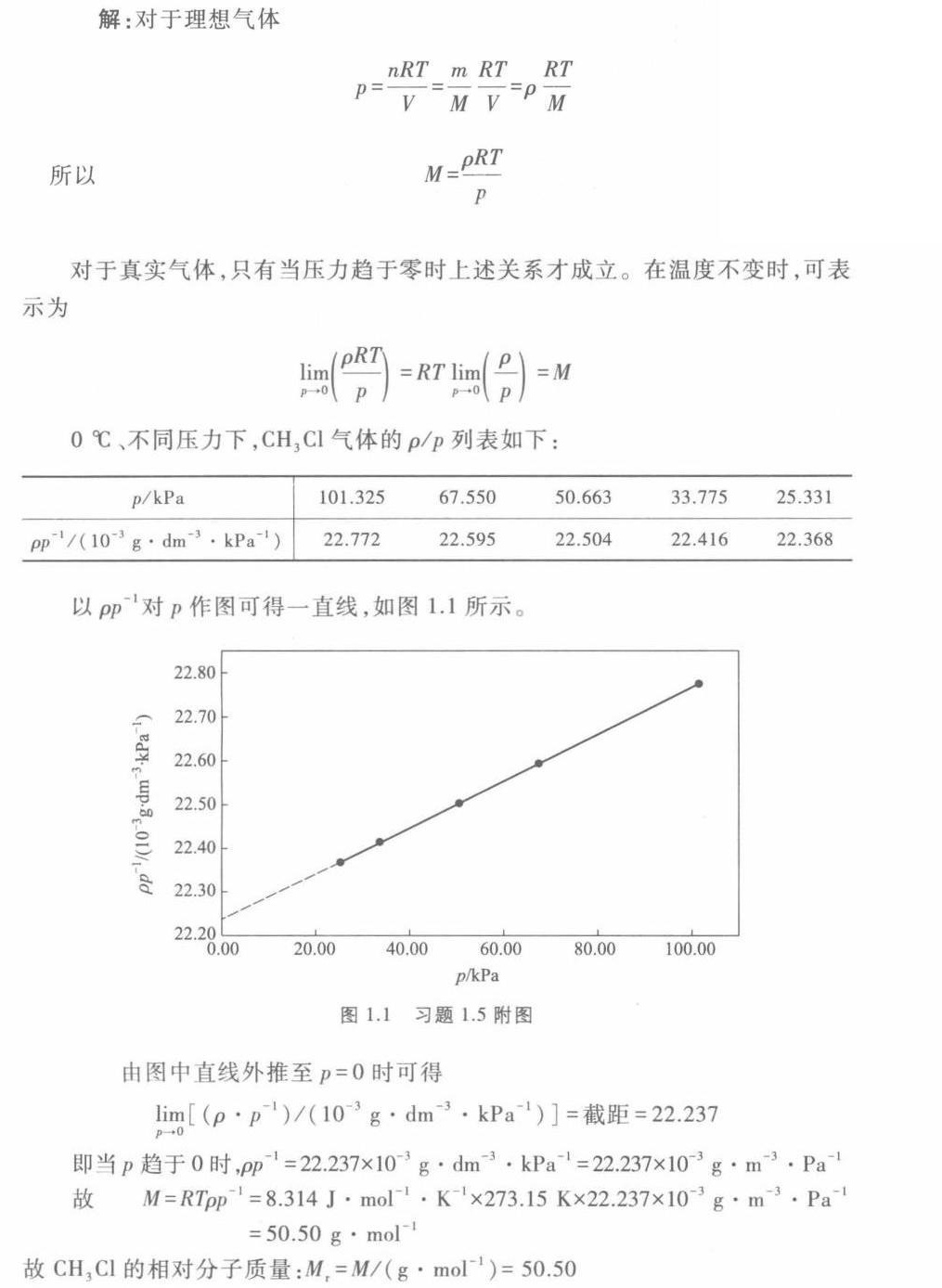
步骤 3:绘制 $\rho {\rho }^{-1}$ 对 $p$ 的关系图
以 $\rho {\rho }^{-1}$ 对 $p$ 作图,得到一条直线。由图中直线外推至 $p=0$ 时,可得 $\lim _{p\rightarrow 0}(\dfrac {p}{\rho })$ 的值。
步骤 4:计算相对分子质量 $M$
根据 $\lim _{p\rightarrow 0}(\dfrac {p}{\rho })$ 的值,计算相对分子质量 $M$。
$\lim _{p\rightarrow 0}(\dfrac {p}{\rho })=22.237\times {10}^{-3}g\cdot {dm}^{-3}\cdot {Pa}^{-1}=22.237\times {10}^{-3}g\cdot {m}^{-3}\cdot {Pa}^{-1}$
$M=\dfrac {RT}{\lim _{p\rightarrow 0}(\dfrac {p}{\rho })}=\dfrac {8.314\times 273.15}{22.237\times {10}^{-3}}=50.50g\cdot {mol}^{-1}$
理想气体状态方程为 $PV=nRT$,其中 $P$ 是压力,$V$ 是体积,$n$ 是物质的量,$R$ 是理想气体常数,$T$ 是温度。对于真实气体,当压力趋于零时,上述关系才成立。因此,可以使用 $\lim _{p\rightarrow 0}(\dfrac {pRT}{p})=RT\lim _{p\rightarrow 0}(\dfrac {p}{p})=M$ 来求解相对分子质量 $M$。
步骤 2:计算 $\rho {\rho }^{-1}$
根据题目给出的数据,计算 $\rho {\rho }^{-1}$,即 $\dfrac {p}{\rho }$,并列出表格。
$p/kPa$ 101.325 67.550 50.663 33.775 25.331
$\rho {\rho }^{-1}/({10}^{-3}g\cdot {dm}^{-3}\cdot kp{a}^{-1})$ 22.772 22.595 22.504 22.416 22.368
步骤 3:绘制 $\rho {\rho }^{-1}$ 对 $p$ 的关系图
以 $\rho {\rho }^{-1}$ 对 $p$ 作图,得到一条直线。由图中直线外推至 $p=0$ 时,可得 $\lim _{p\rightarrow 0}(\dfrac {p}{\rho })$ 的值。
步骤 4:计算相对分子质量 $M$
根据 $\lim _{p\rightarrow 0}(\dfrac {p}{\rho })$ 的值,计算相对分子质量 $M$。
$\lim _{p\rightarrow 0}(\dfrac {p}{\rho })=22.237\times {10}^{-3}g\cdot {dm}^{-3}\cdot {Pa}^{-1}=22.237\times {10}^{-3}g\cdot {m}^{-3}\cdot {Pa}^{-1}$
$M=\dfrac {RT}{\lim _{p\rightarrow 0}(\dfrac {p}{\rho })}=\dfrac {8.314\times 273.15}{22.237\times {10}^{-3}}=50.50g\cdot {mol}^{-1}$