题目
(9)已知反应 _(2)(g)+3(H)_(2)(g)=2N(H)_(3)(g) 的 Delta (H)_(m)^theta (298.15k)=-92.22kJcdot mo(l)^-1-|||-若升高温度, Delta (G)_(m) 将 () , Delta (H)_(m)^theta 将 () , Delta (S)_(m) 将 () ,K^6将 () ;若-|||-减小反应系统体积,平衡将 () 移动;若加入氢气以增加总压力,平衡将 () 移-|||-动;若加入氦气以增加总压力,平衡将 () 移动;若加入氯化氢气体,平衡将 ()-|||-移动。

题目解答
答案
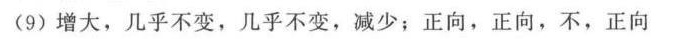
解析
步骤 1:分析温度对 $\Delta {G}_{m}$ 的影响
根据吉布斯自由能公式 $\Delta {G}_{m} = \Delta {H}_{m} - T\Delta {S}_{m}$,当温度升高时,$\Delta {G}_{m}$ 将增大,因为 $\Delta {H}_{m}$ 几乎不变,而 $T\Delta {S}_{m}$ 增大。
步骤 2:分析温度对 ${\Delta }_{1}{H}_{m}^{\theta }$ 的影响
反应的焓变 ${\Delta }_{1}{H}_{m}^{\theta }$ 是一个状态函数,与温度变化无关,因此几乎不变。
步骤 3:分析温度对 ${\Delta }_{1}{S}_{m}$ 的影响
反应的熵变 ${\Delta }_{1}{S}_{m}$ 也是一个状态函数,与温度变化无关,因此几乎不变。
步骤 4:分析温度对 Ke 的影响
根据范特霍夫方程 $\ln \left(\frac{K_{2}}{K_{1}}\right) = -\frac{\Delta H^{\theta}}{R}\left(\frac{1}{T_{2}} - \frac{1}{T_{1}}\right)$,当温度升高时,Ke 减少,因为 $\Delta H^{\theta}$ 为负值。
步骤 5:分析减小反应系统体积对平衡的影响
减小反应系统体积,相当于增加压力,平衡将向气体分子数减少的方向移动,即正向移动。
步骤 6:分析加入氢气以增加总压力对平衡的影响
加入氢气以增加总压力,平衡将向气体分子数减少的方向移动,即正向移动。
步骤 7:分析加入氦气以增加总压力对平衡的影响
加入氦气以增加总压力,但氦气不参与反应,平衡不移动。
步骤 8:分析加入氯化氢气体对平衡的影响
加入氯化氢气体,平衡将向气体分子数减少的方向移动,即正向移动。
根据吉布斯自由能公式 $\Delta {G}_{m} = \Delta {H}_{m} - T\Delta {S}_{m}$,当温度升高时,$\Delta {G}_{m}$ 将增大,因为 $\Delta {H}_{m}$ 几乎不变,而 $T\Delta {S}_{m}$ 增大。
步骤 2:分析温度对 ${\Delta }_{1}{H}_{m}^{\theta }$ 的影响
反应的焓变 ${\Delta }_{1}{H}_{m}^{\theta }$ 是一个状态函数,与温度变化无关,因此几乎不变。
步骤 3:分析温度对 ${\Delta }_{1}{S}_{m}$ 的影响
反应的熵变 ${\Delta }_{1}{S}_{m}$ 也是一个状态函数,与温度变化无关,因此几乎不变。
步骤 4:分析温度对 Ke 的影响
根据范特霍夫方程 $\ln \left(\frac{K_{2}}{K_{1}}\right) = -\frac{\Delta H^{\theta}}{R}\left(\frac{1}{T_{2}} - \frac{1}{T_{1}}\right)$,当温度升高时,Ke 减少,因为 $\Delta H^{\theta}$ 为负值。
步骤 5:分析减小反应系统体积对平衡的影响
减小反应系统体积,相当于增加压力,平衡将向气体分子数减少的方向移动,即正向移动。
步骤 6:分析加入氢气以增加总压力对平衡的影响
加入氢气以增加总压力,平衡将向气体分子数减少的方向移动,即正向移动。
步骤 7:分析加入氦气以增加总压力对平衡的影响
加入氦气以增加总压力,但氦气不参与反应,平衡不移动。
步骤 8:分析加入氯化氢气体对平衡的影响
加入氯化氢气体,平衡将向气体分子数减少的方向移动,即正向移动。