题目
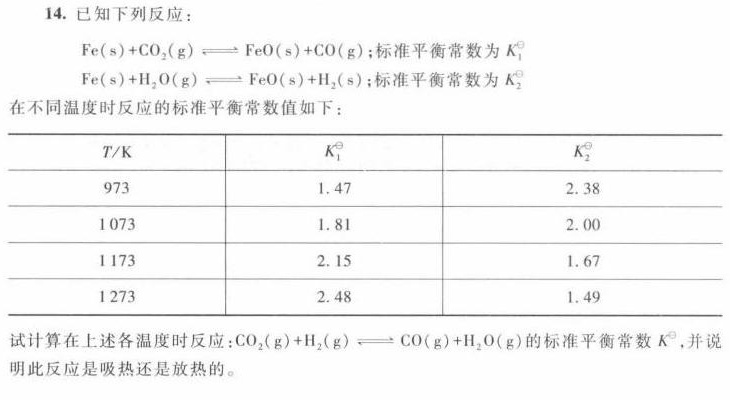
14.已知下列反应:-|||-(s)+C(O)_(2)(g)leftharpoons FeO(s)+CO(g) ;标准平衡常数为K^1/1-|||-(s)+(H)_(2)O(g)leftharpoons FeO(s)+(H)_(2)(s) ;标准平衡常数为K2-|||-在不同温度时反应的标准平衡常数值如下:-|||-/k K? _(2)-|||-973 1.47 2.38-|||-1073 1.81 2.00-|||-1173 2.15 1.67-|||-1273 2.48 1.49-|||-试计算在上述各温度时反应: (O)_(2)(g)+(H)_(2)(g)leftharpoons CO(g)+(H)_(2)O(g) 的标准平衡常数K^并说-|||-明此反应是吸热还是放热的。
题目解答
答案
解析
步骤 1:确定反应方程式和平衡常数
根据题目,我们有以下两个反应:
1. $Fe(s) + CO_2(g) \rightleftharpoons FeO(s) + CO(g)$,标准平衡常数为 $K_1$
2. $Fe(s) + H_2O(g) \rightleftharpoons FeO(s) + H_2(g)$,标准平衡常数为 $K_2$
我们需要计算反应 $CO_2(g) + H_2(g) \rightleftharpoons CO(g) + H_2O(g)$ 的标准平衡常数 $K^\circ$。
步骤 2:利用平衡常数的性质
根据平衡常数的性质,如果两个反应的平衡常数分别为 $K_1$ 和 $K_2$,则这两个反应的逆反应的平衡常数分别为 $1/K_1$ 和 $1/K_2$。同时,如果两个反应可以相加得到一个新的反应,则新反应的平衡常数为两个反应平衡常数的乘积。
因此,我们可以将反应 $Fe(s) + CO_2(g) \rightleftharpoons FeO(s) + CO(g)$ 和反应 $FeO(s) + H_2(g) \rightleftharpoons Fe(s) + H_2O(g)$ 相加得到反应 $CO_2(g) + H_2(g) \rightleftharpoons CO(g) + H_2O(g)$,其平衡常数为 $K^\circ = K_1 \times (1/K_2)$。
步骤 3:计算标准平衡常数 $K^\circ$
根据题目给出的数据,我们可以计算出在不同温度下反应 $CO_2(g) + H_2(g) \rightleftharpoons CO(g) + H_2O(g)$ 的标准平衡常数 $K^\circ$。
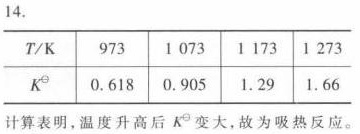
- 在 973 K 时,$K^\circ = K_1 \times (1/K_2) = 1.47 \times (1/2.38) = 0.618$
- 在 1073 K 时,$K^\circ = K_1 \times (1/K_2) = 1.81 \times (1/2.00) = 0.905$
- 在 1173 K 时,$K^\circ = K_1 \times (1/K_2) = 2.15 \times (1/1.67) = 1.29$
- 在 1273 K 时,$K^\circ = K_1 \times (1/K_2) = 2.48 \times (1/1.49) = 1.66$
步骤 4:判断反应是吸热还是放热
根据计算结果,我们可以看出,随着温度的升高,标准平衡常数 $K^\circ$ 逐渐增大,说明反应是吸热的。
根据题目,我们有以下两个反应:
1. $Fe(s) + CO_2(g) \rightleftharpoons FeO(s) + CO(g)$,标准平衡常数为 $K_1$
2. $Fe(s) + H_2O(g) \rightleftharpoons FeO(s) + H_2(g)$,标准平衡常数为 $K_2$
我们需要计算反应 $CO_2(g) + H_2(g) \rightleftharpoons CO(g) + H_2O(g)$ 的标准平衡常数 $K^\circ$。
步骤 2:利用平衡常数的性质
根据平衡常数的性质,如果两个反应的平衡常数分别为 $K_1$ 和 $K_2$,则这两个反应的逆反应的平衡常数分别为 $1/K_1$ 和 $1/K_2$。同时,如果两个反应可以相加得到一个新的反应,则新反应的平衡常数为两个反应平衡常数的乘积。
因此,我们可以将反应 $Fe(s) + CO_2(g) \rightleftharpoons FeO(s) + CO(g)$ 和反应 $FeO(s) + H_2(g) \rightleftharpoons Fe(s) + H_2O(g)$ 相加得到反应 $CO_2(g) + H_2(g) \rightleftharpoons CO(g) + H_2O(g)$,其平衡常数为 $K^\circ = K_1 \times (1/K_2)$。
步骤 3:计算标准平衡常数 $K^\circ$
根据题目给出的数据,我们可以计算出在不同温度下反应 $CO_2(g) + H_2(g) \rightleftharpoons CO(g) + H_2O(g)$ 的标准平衡常数 $K^\circ$。
- 在 973 K 时,$K^\circ = K_1 \times (1/K_2) = 1.47 \times (1/2.38) = 0.618$
- 在 1073 K 时,$K^\circ = K_1 \times (1/K_2) = 1.81 \times (1/2.00) = 0.905$
- 在 1173 K 时,$K^\circ = K_1 \times (1/K_2) = 2.15 \times (1/1.67) = 1.29$
- 在 1273 K 时,$K^\circ = K_1 \times (1/K_2) = 2.48 \times (1/1.49) = 1.66$
步骤 4:判断反应是吸热还是放热
根据计算结果,我们可以看出,随着温度的升高,标准平衡常数 $K^\circ$ 逐渐增大,说明反应是吸热的。