题目
将4molSO2与2molO2放入4L的密闭容器中,在一定条件下反应达到平衡:2SO2+O2⇌2SO3,测得平衡时SO3的浓度为0.5mol·L-1,则此条件下的平衡常数K为() A.4 B.0.25 C.0.4 D.0.2
将4molSO2与2molO2放入4L的密闭容器中,在一定条件下反应达到平衡:2SO2+O2⇌2SO3,测得平衡时SO3的浓度为0.5mol·L-1,则此条件下的平衡常数K为()
A.4
B.0.25
C.0.4
D.0.2
题目解答
答案
A。
解:c(SO2)=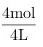 =1mol·L-1,c(O2)=
=1mol·L-1,c(O2)=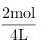 =0.5mol·L-1,平衡时SO3的浓度为0.5mol·L-1,则:
=0.5mol·L-1,平衡时SO3的浓度为0.5mol·L-1,则:

平衡常数K=K=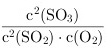 =
=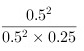 =4。
=4。
故选A。
解析
步骤 1:计算起始浓度
根据题目,4mol SO_2和2mol O_2放入4L的密闭容器中,可以计算出起始浓度。
- SO_2的起始浓度为:4mol / 4L = 1mol·L^{-1}
- O_2的起始浓度为:2mol / 4L = 0.5mol·L^{-1}
步骤 2:确定平衡浓度
题目给出平衡时SO_3的浓度为0.5mol·L^{-1},根据化学反应方程式2SO_2 + O_2 ⇌ 2SO_3,可以确定SO_2和O_2的平衡浓度。
- SO_3的浓度为0.5mol·L^{-1},则SO_2的浓度减少了0.5mol·L^{-1},O_2的浓度减少了0.25mol·L^{-1}。
- SO_2的平衡浓度为:1mol·L^{-1} - 0.5mol·L^{-1} = 0.5mol·L^{-1}
- O_2的平衡浓度为:0.5mol·L^{-1} - 0.25mol·L^{-1} = 0.25mol·L^{-1}
步骤 3:计算平衡常数K
根据平衡常数的定义,K = [SO_3]^2 / ([SO_2]^2 * [O_2])。
- K = (0.5mol·L^{-1})^2 / ((0.5mol·L^{-1})^2 * 0.25mol·L^{-1}) = 4
根据题目,4mol SO_2和2mol O_2放入4L的密闭容器中,可以计算出起始浓度。
- SO_2的起始浓度为:4mol / 4L = 1mol·L^{-1}
- O_2的起始浓度为:2mol / 4L = 0.5mol·L^{-1}
步骤 2:确定平衡浓度
题目给出平衡时SO_3的浓度为0.5mol·L^{-1},根据化学反应方程式2SO_2 + O_2 ⇌ 2SO_3,可以确定SO_2和O_2的平衡浓度。
- SO_3的浓度为0.5mol·L^{-1},则SO_2的浓度减少了0.5mol·L^{-1},O_2的浓度减少了0.25mol·L^{-1}。
- SO_2的平衡浓度为:1mol·L^{-1} - 0.5mol·L^{-1} = 0.5mol·L^{-1}
- O_2的平衡浓度为:0.5mol·L^{-1} - 0.25mol·L^{-1} = 0.25mol·L^{-1}
步骤 3:计算平衡常数K
根据平衡常数的定义,K = [SO_3]^2 / ([SO_2]^2 * [O_2])。
- K = (0.5mol·L^{-1})^2 / ((0.5mol·L^{-1})^2 * 0.25mol·L^{-1}) = 4