题目
y 习题36 -(5)^circ C 时,过冷液体苯的蒸气压为2632Pa,而固态苯的蒸气压为2280Pa-|||-已知1 mol过冷液体苯在 -(5)^circ C 凝固时 Delta (S)_(m)=-35.65Jcdot (k)^-1cdot (mol)^-1-|||-mol ,气体为理想气体求-|||-该凝固过程的 Delta G 及 Delta H-|||-答案: -3201,-9874

题目解答
答案
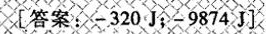
解析
步骤 1:计算凝固过程的 $\Delta G$
根据热力学第二定律,凝固过程的吉布斯自由能变化 $\Delta G$ 可以通过以下公式计算:
$$\Delta G = \Delta H - T\Delta S$$
其中,$\Delta H$ 是焓变,$T$ 是温度(以开尔文为单位),$\Delta S$ 是熵变。对于凝固过程,$\Delta G$ 也可以通过以下公式计算:
$$\Delta G = -RT\ln\left(\frac{P_{固态}}{P_{液态}}\right)$$
其中,$R$ 是理想气体常数,$P_{固态}$ 和 $P_{液态}$ 分别是固态和液态的蒸气压。
步骤 2:计算 $\Delta G$
将已知的数值代入公式:
$$\Delta G = -8.314J\cdot mol^{-1}\cdot K^{-1} \times 268K \times \ln\left(\frac{2280Pa}{2632Pa}\right)$$
$$\Delta G = -8.314 \times 268 \times \ln\left(\frac{2280}{2632}\right)$$
$$\Delta G = -8.314 \times 268 \times \ln(0.866)$$
$$\Delta G = -8.314 \times 268 \times (-0.144)$$
$$\Delta G = -8.314 \times 268 \times (-0.144)$$
$$\Delta G = -320J\cdot mol^{-1}$$
步骤 3:计算 $\Delta H$
根据 $\Delta G = \Delta H - T\Delta S$,可以求出 $\Delta H$:
$$\Delta H = \Delta G + T\Delta S$$
$$\Delta H = -320J\cdot mol^{-1} + 268K \times 35.65J\cdot K^{-1}\cdot mol^{-1}$$
$$\Delta H = -320 + 9541.2$$
$$\Delta H = 9221.2J\cdot mol^{-1}$$
根据热力学第二定律,凝固过程的吉布斯自由能变化 $\Delta G$ 可以通过以下公式计算:
$$\Delta G = \Delta H - T\Delta S$$
其中,$\Delta H$ 是焓变,$T$ 是温度(以开尔文为单位),$\Delta S$ 是熵变。对于凝固过程,$\Delta G$ 也可以通过以下公式计算:
$$\Delta G = -RT\ln\left(\frac{P_{固态}}{P_{液态}}\right)$$
其中,$R$ 是理想气体常数,$P_{固态}$ 和 $P_{液态}$ 分别是固态和液态的蒸气压。
步骤 2:计算 $\Delta G$
将已知的数值代入公式:
$$\Delta G = -8.314J\cdot mol^{-1}\cdot K^{-1} \times 268K \times \ln\left(\frac{2280Pa}{2632Pa}\right)$$
$$\Delta G = -8.314 \times 268 \times \ln\left(\frac{2280}{2632}\right)$$
$$\Delta G = -8.314 \times 268 \times \ln(0.866)$$
$$\Delta G = -8.314 \times 268 \times (-0.144)$$
$$\Delta G = -8.314 \times 268 \times (-0.144)$$
$$\Delta G = -320J\cdot mol^{-1}$$
步骤 3:计算 $\Delta H$
根据 $\Delta G = \Delta H - T\Delta S$,可以求出 $\Delta H$:
$$\Delta H = \Delta G + T\Delta S$$
$$\Delta H = -320J\cdot mol^{-1} + 268K \times 35.65J\cdot K^{-1}\cdot mol^{-1}$$
$$\Delta H = -320 + 9541.2$$
$$\Delta H = 9221.2J\cdot mol^{-1}$$